Bảng tuần hoàn hóa học chuẩn
Hóa học là môn học quan trọng đối với các bạn theo khoa học tự nhiên, ngoài những kiến thức các bạn học hỏi trên lớp thì lượng kiến thức mà bảng tuần hoàn hóa học mang lại cực kỳ lớn mà các bạn không thể bỏ qua. Việc nắm vững các tên nguyên tố, ký hiệu hóa học, số hóa trị, vị trí các nguyên tố hóa học trên bảng tuần hoàn giúp các bạn có thể dễ dàng lý giải, suy đoán chính xác về chất, hợp chất hóa học.
Các bạn đang tìm kiếm bảng tuần hoàn hóa học chuẩn để tìm hiểu và học tập, nâng cao kiến thức hóa học cho mình? Vậy các bạn hãy tham khảo bài viết dưới đây.

Bài viết giới thiệu về bảng tuần hoàn các nguyên tố hóa học, bố cục và cách sắp xếp của bảng tuần hoàn.
1. Giới thiệu về bảng tuần hoàn hóa học
Tên đầy đủ là bảng tuần hoàn các nguyên tố hóa học hay bảng tuần hoàn Mendeleev thường gọi tắt là bảng tuần hoàn là phương pháp liệt kê các nguyên tố hóa học thành bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng.
Các nguyên tố được sắp xếp theo thứ tự số hiệu nguyên tử tăng dần cùng với ký hiệu hóa học trong mỗi ô. Dạng tiêu chuẩn của bảng tuần hoàn gồm các nguyên tố được sắp xếp thành 18 cột và 7 dòng với hai dòng kép nằm riêng bên dưới.
Bảng tuần hoàn được công bố lần đầu tiên vào năm 1869 bởi Mendeleev, nó đã trở thành tài liệu quan trọng cho các công trình nghiên cứu và đạt được nhiều thành tựu. Bảng tuần hoàn đã giúp con người hiểu được các định luật vận hành của thế giới được ứng dụng vào nhiều lĩnh vực trong đời sống, tạo tiền đề cho sự phát triển của lĩnh vực nguyên tử sau này.
2. Bố cục bảng tuần hoàn hóa học dạng tiêu chuẩn
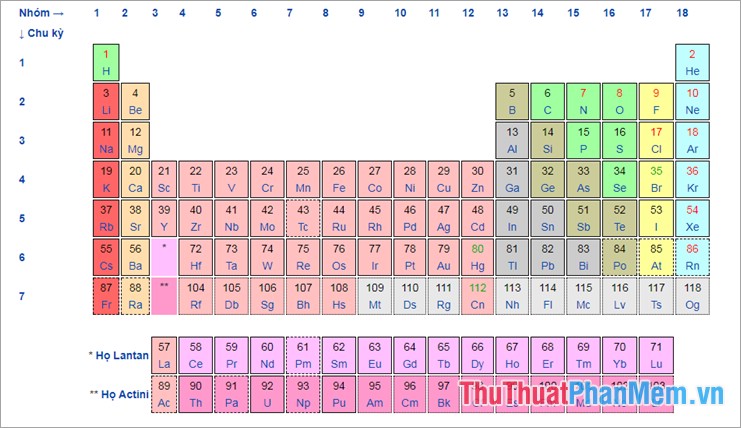
Trong đó:
Màu của số hiệu nguyên tử thể hiện trạng thái vật chất (ở \({0^o}C\) và 1 atm):
- Màu đen: chất rắn.
- Màu lục: chất lỏng.
- Màu đỏ: chất khí.
Đường viền ô nguyên tố thể hiện sự hiện diện trong tự nhiên của nguyên tố.
- Nét liền: nguyên tố nguyên thủy.
- Nét đứt: nguyên tố từ phân rã.
- Dấu chấm: nguyên tố tổng hợp
Màu ô nguyên tố thể hiện các nhóm cùng gốc trong bảng tuần hoàn.

3. Phương pháp sắp xếp
- Nhóm
Nhóm hay còn được gọi là một họ, là một cột đứng trong bảng tuần hoàn, các nhóm thường thể hiện nhiều xu hướng tuần hoàn quan trọng hơn là các chu kỳ và các khối.
Các thuyết về cấu trúc nguyên tử trong cơ học lượng tử hiện đại giải thích rằng các nguyên tố trong cùng một nhóm có cấu hình electron như nhau trong lớp hóa trị của chúng, và do đó các nguyên tố trong cùng một nhóm có tính chất hóa học giống nhau và thể hiện một xu hướng rõ ràng trong các tính chất với số hiệu nguyên tử tăng dần. Tuy nhiên, trong một vài phần của bảng tuần hoàn, tính tương đồng theo chiều ngang có thể quan trọng không kém, hoặc thậm chí quan trọng hơn, tính tương đồng theo chiều dọc.
Từ trên xuống trong cùng một nhóm, bán kính nguyên tử tăng dần. Do có nhiều mức năng lượng được lấp đầy hơn, các electron hóa trị xuất hiện ở xa hạt nhân hơn.
Từ trên xuống, các nguyên tố sau có mức năng lượng ion hóa thấp hơn, tức là dễ tách electron ra khỏi nguyên tử bởi liên kết lỏng lẻo đi.
Tương tự, trong một nhóm từ trên xuống sẽ giảm độ âm điện do khoảng cách giữa các electron hóa trị và hạt nhân tăng dần. Tuy nhiên các xu hướng này cũng có ngoại lệ, ví dụ trong nhóm 11 thì độ âm điện tăng từ trên xuống.
- Chu kỳ
Một chu kỳ là một hàng ngang trong bảng tuần hoàn. Mặc dù nhóm thông thường có các xu hướng quan trọng hơn, có những vùng trong bảng mà xu hướng theo chiều ngang quan trọng hơn chiều dọc, như ở khối f, với các họ Lantan và họ Actini tạo nên hai chuỗi hàng ngang quan trọng.
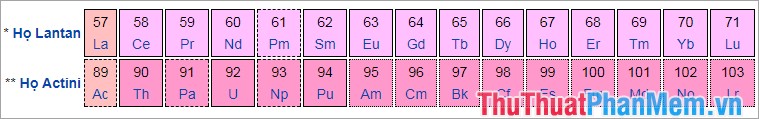
Trong một chu kì từ trái sang phải, bán kính nguyên tử giảm dần do mỗi nguyên tố thêm vào proton khiến cho electron lớp ngoài bị kéo lại gần hạt nhân hơn. Bán kính nguyên tử giảm làm năng lượng ion hóa và độ âm điện tăng dần.
- Khối
Các vùng khác nhau trên bảng tuần hoàn đôi khi được xem là "khối" theo cách mà các vỏ electron của các nguyên tố được lấp đầy. Mỗi lớp được đặt tên theo sự sắp xếp các electron cuối cùng trong vỏ.
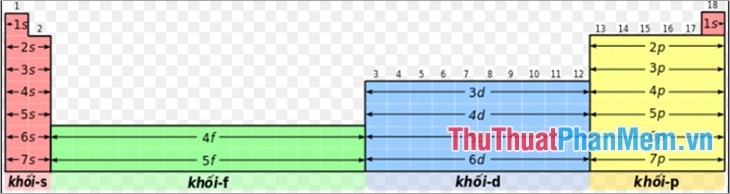
Khối s gồm hai nhóm đầu tiên (kim loại kiềm và kiềm thổ) cũng như hydro và heli.
Khối p gồm 6 nhóm cuối từ nhóm 13 đến 18 theo IUPAC, trong đó có tất cả các á kim và một số kim loại cùng phi kim.
Khối d gồm các nhóm thứ 3 đến 12 theo IUPAC và chứa tất cả kim loại chuyển tiếp.
Khối f, thường xếp riêng bên dưới bản tuần hoàn, gồm những nguyên tố kim loại thuộc các họ lantan và actini.
- Phân loại và các quy ước khác
Theo tính chất, các nguyên tố trong bảng tuần hoàn có thể chia làm các loại chính: kim loại, phi kim và á kim.
Kim loại thường nằm bên trái và phía dưới bảng tuần hoàn, chúng là chất rắn, có ánh kim, dẫn điện và nhiệt tốt, có thể tạo thành hợp kim với nhau và hợp chất với phi kim. Phi kim nằm ở bên phải và phía trên, là các khí có màu hoặc không màu, cách điện và nhiệt, hình thành hợp chất hóa trị với nhau. Ở giữa kim loại và phi kim là á kim, có tính chất trung gian hoặc kết hợp giữa kim loại và phi kim. Các nguyên tố giảm tính kim loại và tăng tính phi kim từ trái sang phải.
Kim loại chia làm: kim loại kiềm hoạt động mạnh, kim loại kiềm thổ ít hoạt động hơn, họ lantan và actini, kim loại chuyển tiếp nguyên hình (gồm cả kim loại chịu nhiệt, kim loại hiếm) và kim loại yếu hơn về hóa học lẫn vật lý. Phi kim chia làm: phi kim đa nguyên tử, nằm gần á kim nhất thể hiện chút ít đặc tính kim loại; phi kim hai nguyên tử, thể hiện tính phi kim rõ ràng; phi kim đơn nguyên tử (khí hiếm) gần như hoàn toàn trơ và phi kim.

Quy ước về bố cục bảng tuần hoàn, họ lantan và họ actino thường thể hiện thành hai hàng dưới thân chính của bảng tuần hoàn. Cũng có dạng bảng rộng (hiếm gặp) chèn các họ nguyên tố này vào vị trí chính xác của chúng (một phần của chu kỳ 6, chu kỳ 7).
Như vậy, bài viết đã giới thiệu về bảng tuần hoàn các nguyên tố hóa học, bố cục bảng tuần hoàn cùng với các quy tắc sắp xếp bảng tuần hoàn. Hi vọng với những gì bài viết đã trình bày thì các bạn sẽ dễ dàng hơn khi tìm hiểu và học thuộc bảng tuần hoàn. Chúc các bạn thành công!